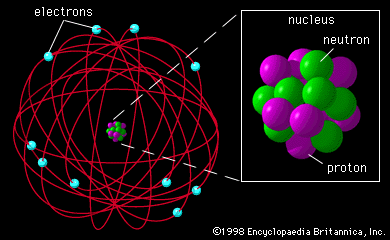
- En el modelo de Rutherford, los electrones se movían alrededor del núcleo como los planetas alrededor del sol. Los electrones no caían en el núcleo, ya que la fuerza de atracción electrostática era contrarrestada por la tendencia del electrón a continuar moviéndose en línea recta.
El electrón se encuentra girando alrededor de del núcleo; describiendo órbitas circulares de forma similar a los planetas que giran alrededor del sol; denominándose Sistema planetario en miniatura.
La fuerza centrífuga que desarrolla al girar el electrón, contrarresta la fuerza de atracción electrostática que ejerce el núcleo (+) sobre el electrón (-).
El diámetro del átomo es aproximadamente unas 10000 veces mayor que el diámetro del núcleo. Por lo tanto, el átomo es prácticamente hueco, al poseer espacios interatómicos
Experimento "La lámina de oro"
Antes de la propuesta de Rutherford, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos deflactados por las partículas upuestamente aportarían información sobre cómo era la distribución de carga en los átomos. En concreto, era de esperar que si las cargas estaban distribuidas acordemente al modelo de Thomson la mayoría de las partículas atravesarían la delgada lámina sufriendo sólo ligerísimas deflacciones en su trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.

